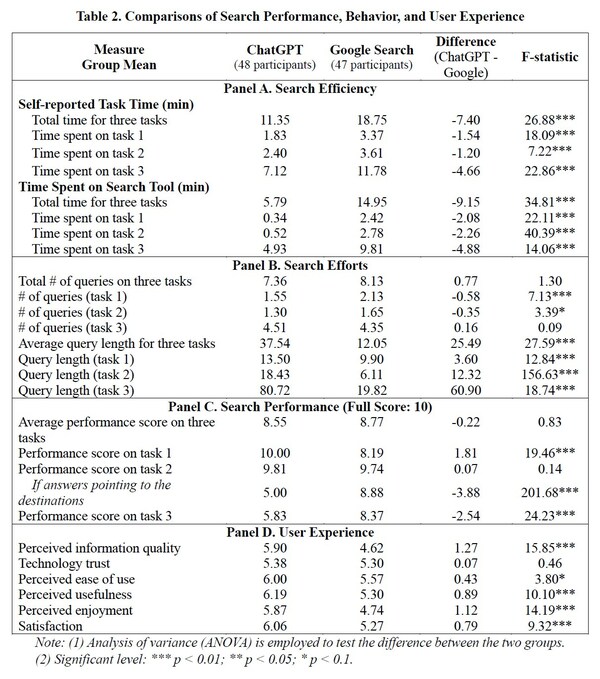
纳米胶囊的协同处理,肿瘤生长抑制率为87.2%。
2020-09-10 09:25 来源: 互联网 阅读次数:3563
科技日报讯,记者从华东理工大学获悉,药学学院教授朱卫平研制了一种自加速过氧化氢刺激反应金囊,实现了对小鼠肿瘤化疗和饥饿的协同治疗,相关结果发表在国际知名生物医学杂志"热学"上。
有机-无机杂化纳米小泡集有机材料的高生物相容性以及无机材料独特的光学、电学和磁性于一体,具有良好的载药能力。近年来,人们越来越重视癌症的诊断、治疗和成像领域,其中具有可调近红外吸收的金纳米小泡在光基成像或治疗模式下取得了良好的诊断和治疗效果。然而,由于近红外光的穿透深度有限,以往报道的金纳米小泡在深部组织肿瘤的治疗中仍面临着巨大的挑战。

过氧化氢是细胞内多种代谢途径的副产品,主要产生于线粒体。癌细胞中线粒体的功能紊乱,癌细胞在快速增殖过程中将继续产生大量的过氧化氢。鉴于这一特点,朱卫平与复旦大学聂志红教授合作,设计并制备了过氧化氢刺激金纳米囊TG-GV,并将其包裹在TPZ(TPZ)和葡萄糖氧化酶(Gox)中,实现肿瘤部位的特异性释放。
在肿瘤部位高浓度过氧化氢氧化作用下,TG-GV表面的两亲聚合物中的疏水碎片转变为亲水态,导致囊泡崩解,TPZ和Gox释放。其中,Gox能氧化肿瘤部位的葡萄糖,产生饥饿效应,同时消耗大量氧气,加重肿瘤的缺氧状态,激活缺氧前体TPZ成为毒性自由基,杀伤癌细胞。在葡萄糖氧化过程中,Gox产生大量的过氧化氢,进一步刺激囊泡释放更多的药物,从而产生"自加速"药物释放效应。小泡对4T1移植瘤小鼠具有良好的抑瘤作用,抑瘤率达87.2%。已经证明,化疗和饥饿疗法具有协同治疗的作用。
本研究突破了以往金纳米小泡仅限于光控治疗的局限,巧妙地利用肿瘤微环境的特点,设计出具有内在刺激反应的载药金纳米小泡,拓宽了金纳米小泡的应用领域,为有机无机纳米小泡的设计和应用提供了新的思路。
责任编辑:无量渡口
【慎重声明】凡本站未注明来源为"中关村热线"的所有作品,均转载、编译或摘编自其它媒体,转载、编译或摘编的目的在于传递更多信息,并不代表本站赞同其观点和对其真实性负责。如因作品内容、版权和其他问题需要同本网联系的,请在30日内进行!
推荐